
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
Bosutinib CAS 380843-75-4
2023-08-21
Chemický název:
4-(2,4-dichlor-5-methoxyanilino)-6-methoxy-7-[3-(4-methylpiperazin-1-yl)propoxy]chinolin-3-karbonitril
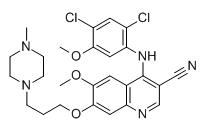
M.F:C26H29CI2N5O3
Chemické vlastnosti:Světle žlutá pevná látka
Bosutinib je inhibitor Bcr-Abl kinázy pro léčbu chronické myeloidní leukémie (CML) s pozitivním Philadelphia chromozomem (Ph+). Ve srovnání s jinými inhibitory tyrosinkinázy má příznivější profil hematologické toxicity. FDA schváleno 4. září 2012.
Zlepšovatel:Wyeth Pharmaceuticals (Pfizer) (USA)
Aplikace:
Účinky na buněčnou morfologii byly pozorovány při koncentraci 1 uM SKI-606 pro všechny zkoumané buněčné linie a morfologické změny byly zjevné při koncentracích tak nízkých, jako je 0,25 uM. SKI-606 způsobil, že buňky k sobě přilnuly a vytvořily husté shluky ve srovnání s buňkami ošetřenými vehikulem (DMSO), které vykazovaly šíření na větší plochy.
Dávková forma: Perorální podání, 100 mg/kg/den, po dobu 28 dnů
Meziprodukty:
CAS č. 2031-23-4 1-(3-Chlorpropyl)-4-methylpiperazin dihydrochlorid
CAS č. 214470-66-3 7-(3-chlorpropoxy)-4-hydroxy-6-methoxychinolin-3-karbonitril
CAS č. 214470-68-5 4-CHLORO-7-(3-CHLORO-PROPOXY)-6-METOXY-CHINOLIN-3-KARBONITRIL
Č. CAS 263149-10-6 4-CHLORO-7-HYDROXY-6-METOXY-CHINOLIN-3-KARBONITRIL
Č. CAS 380844-49-5 7-(3-CHLORO-PROPOXY)-4-(2,4-DICHLORO-5-METOXY-FENYLAMINO)-6-METOXY-CHINOLIN-3-KARBONITRIL
Cílený lék Bsutinib (Bosulif) byl schválen FOOD and Drug Administration (FDA) pro léčbu chronické myeloidní leukémie. Besutinib je inhibitor kinázy, který inhibuje signální dráhy Abl a Src. Podle oznámení společnosti Pfizer Oncology je lék určen k léčbě chronických, akcelerovaných nebo akutních dospělých pacientů s CML s pozitivním Philadelphia chromozomem (Ph+) s předchozí lékovou rezistencí nebo intolerancí. Asi třetina pacientů s CML nereaguje dobře na léčbu standardním lékem první linie Gleevec, řekl Pfizer. Přibližně polovina pacientů, u kterých se rozvine rezistence nebo intolerance na imatinib, také špatně reaguje na jiné inhibitory tyrosinkinázy (TKI) druhé linie, uvedla společnost.
Schválení perorálního léku bylo založeno především na klinických studiích fáze I a fáze II zahrnujících 500 pacientů s PH-pozitivní CML, kteří nereagovali na imatinib nebo jej netolerovali, včetně různých skupin v chronickém, akcelerovaném a akutním stádiu. Podle údajů z klinické studie společnosti Pfizer třetina pacientů dříve léčených samotným imatinibem dosáhla velké cytogenetické remise po 24 týdnech užívání bosutinibu (500 mg jednou denně). U pacientů, kteří dostávali imatinib a další inhibitor tyrozinkinázy (dasatinib, Sprycel), 27 % dosáhlo velké cytogenetické remise. Míra odezvy nadále rostla v obou skupinách po 24 nebo více týdnech léku, řekl Pfizer. Pfizer poznamenává, že pouze 4 procenta pacientů s chronickým onemocněním po užití Besutinibu projdou do pokročilého nebo akutního stadia. Nežádoucí účinky stupně 3-4 zahrnují trombocytopenii (26 %), neutropenii (11 %), průjem (9 %), anémii (9 %) a kožní vyrážku (8 %).
Bosutris (Bosutinib) Bosutinib byl původně vyvinut společností Pfizer a byl poprvé schválen ve Spojených státech v září 2012 pro použití u dospělých s Ph+CML, kteří měli v minulosti rezistenci nebo intoleranci na léčbu v chronických, akcelerovaných nebo akutních stádiích . BOSULIF je první lék od společnosti Pfizer k léčbě hematologických nádorů a představuje důležitou možnost léčby pacientů s Ph+CML s předchozí lékovou rezistencí nebo intolerancí. Tato rozšířená indikace má potenciál mít ještě větší dopad na životy pacientů s chronickou myeloidní leukémií.
Dne 13. července 2020 indický Mylan Pharmaceutical zahájil komerční uvedení generického generického Bosutrisu Bosutinib (Bosutinib/Bosutinib/Bosutinib). Obecná verze Bosutris od Mylan stojí asi o 25 % méně než původní Bosulif od Pfizeru. (Také: Upjohn, generická pobočka společnosti Pfizer, se letos spojí se společností Mylan a vytvoří společnost Viatris, největší světovou generickou společnost, která bude dokončena ve čtvrtém čtvrtletí roku 2020.)




